Eine wissenschaftliche Analyse unter besonderer Berücksichtigung von EEG-, ERP- und Microstate-Biomarkern
Zusammenfassung
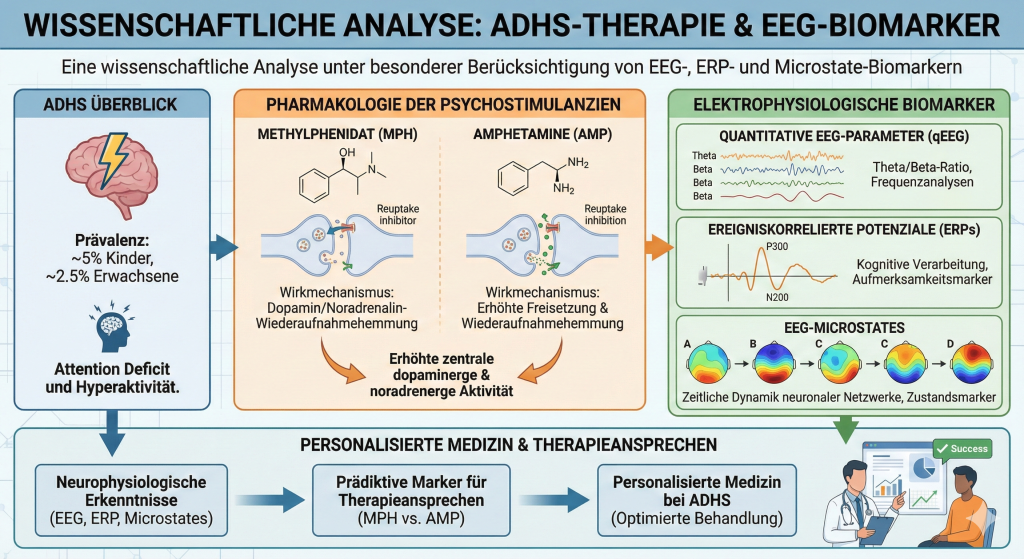
Die Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) ist eine der häufigsten neurodevelopmentalen Störungen, die weltweit etwa 5% der Kinder und 2,5% der Erwachsenen betrifft. Psychostimulanzien, insbesondere Methylphenidat (MPH) und Amphetamine (AMP), stellen die pharmakologische Erstlinientherapie dar. Obwohl beide Substanzklassen die zentrale dopaminerge und noradrenerge Aktivität erhöhen, unterscheiden sie sich fundamental in ihren Wirkmechanismen. Diese Abhandlung analysiert die pharmakologischen Unterschiede beider Substanzklassen und deren Implikationen für die klinische Anwendung. Ein besonderer Fokus liegt auf elektrophysiologischen Biomarkern, einschließlich quantitativer EEG-Parameter, ereigniskorrelierten Potenzialen (ERPs) und EEG-Microstates, die als prädiktive Marker für das Therapieansprechen dienen könnten. Die Integration dieser neurophysiologischen Erkenntnisse in die klinische Praxis könnte einen wichtigen Schritt in Richtung einer personalisierten Medizin bei ADHS darstellen.
1. Einleitung
Die Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) repräsentiert eine der am gründlichsten erforschten neurologischen Erkrankungen der modernen Medizin. Sie manifestiert sich durch persistierende Muster von Unaufmerksamkeit, Hyperaktivität und Impulsivität, die das akademische, berufliche und soziale Funktionieren beeinträchtigen. Die weltweite Prävalenz wird auf etwa 5,29% bei Kindern und Jugendlichen sowie 2,5-4,4% bei Erwachsenen geschätzt. Die jährlichen gesellschaftlichen Kosten belaufen sich allein in den USA auf geschätzte 143-266 Milliarden US-Dollar.
Die pharmakologische Behandlung von ADHS stützt sich primär auf zwei Substanzklassen von Psychostimulanzien: Methylphenidat-basierte Präparate und Amphetamin-Derivate. Obwohl beide Substanzklassen seit Jahrzehnten erfolgreich eingesetzt werden und eine Response-Rate von etwa 70% aufweisen, reagiert eine signifikante Subgruppe von Patienten unterschiedlich auf die verschiedenen Stimulanzien. Diese Beobachtung legt nahe, dass trotz ähnlicher klinischer Wirksamkeit grundlegende pharmakologische und neurophysiologische Unterschiede existieren.
Die Identifikation verlässlicher Biomarker zur Vorhersage des individuellen Therapieansprechens stellt einen wichtigen Schritt in Richtung einer personalisierten Medizin dar. Elektrophysiologische Methoden, insbesondere das Elektroenzephalogramm (EEG) und ereigniskorrelierte Potenziale (ERPs), bieten vielversprechende Möglichkeiten zur Charakterisierung neurophysiologischer Subgruppen und zur Prädiktion des Behandlungserfolgs.
2. Pharmakologische Wirkmechanismen
2.1 Gemeinsame Wirkprinzipien
Der primäre pharmakologische Effekt sowohl von Methylphenidat als auch von Amphetaminen besteht in der Erhöhung der zentralen Dopamin- und Noradrenalin-Aktivität. Diese Katecholamine spielen eine zentrale Rolle in den exekutiven und attentionalen Funktionen des präfrontalen Kortex. Die Ätiologie der ADHS ist komplex und umfasst multiple genetische und nicht-genetische Faktoren. Aktuelle Evidenz konvergiert jedoch in der Annahme, dass die Katecholamin-Neurotransmission in den Gehirnen von ADHS-Patienten beeinträchtigt ist.
Unter normalen Umständen reguliert der präfrontale Kortex Aufmerksamkeit, Verhalten und Emotionen. Defizite in der Funktion des präfrontalen Kortex wurden mit ADHS-Symptomen wie mangelnder Impulskontrolle, eingeschränkter Daueraufmerksamkeit und erhöhter Ablenkbarkeit in Verbindung gebracht. Sowohl Stimulanzien als auch der Nicht-Stimulant Atomoxetin erhöhen die synaptischen Katecholamin-Konzentrationen im Gehirn, insbesondere im präfrontalen Kortex.
2.2 Spezifische Wirkmechanismen von Methylphenidat
Methylphenidat wirkt primär als Wiederaufnahmehemmer von Dopamin und Noradrenalin. Der Wirkmechanismus basiert auf der Blockade der präsynaptischen Dopamin- und Noradrenalin-Transporter, was zu einer erhöhten Verfügbarkeit dieser Neurotransmitter im synaptischen Spalt führt. Im Gegensatz zu Amphetaminen fördert Methylphenidat nicht die Freisetzung von Dopamin aus synaptischen Vesikeln.
Zusätzliche Wirkmechanismen von Methylphenidat umfassen eine agonistische Aktivität am Serotonin-1A-Rezeptor sowie eine Umverteilung des vesikulären Monoamin-Transporters 2 (VMAT-2). Es gibt auch Hinweise auf Interaktionen mit Glutamat- und Opioid-Systemen. Diese Mechanismen tragen möglicherweise zu den spezifischen klinischen Effekten und Nebenwirkungsprofilen bei.
2.3 Spezifische Wirkmechanismen von Amphetaminen
Amphetamine zeigen ein komplexeres pharmakologisches Profil als Methylphenidat. Neben der Hemmung der Dopamin- und Noradrenalin-Transporter bewirken Amphetamine auch eine Hemmung des vesikulären Monoamin-Transporters 2 (VMAT-2) und eine Inhibition der Monoaminoxidase-Aktivität. Der entscheidende Unterschied zu Methylphenidat liegt in der Fähigkeit von Amphetaminen, eine aktive Freisetzung von Katecholaminen aus den präsynaptischen Nervenendigungen zu bewirken.
Amphetamin existiert als zwei Stereoisomere mit unterschiedlichen Wirkprofilen. Das l-Enantiomer (Levoamphetamin) produziert mehr kardiovaskuläre und periphere Effekte als das d-Enantiomer (Dextroamphetamin). Bei niedrigen Dosen erzeugt Levoamphetamin eine stärkere Erregung als Dextroamphetamin und wirkt primär auf Noradrenalin. Bei höheren Dosen zeigt Dextroamphetamin stimulierende Eigenschaften, die drei- bis viermal stärker sind als die von Levoamphetamin, und wirkt primär auf Dopamin.
2.4 Klinische Implikationen der pharmakologischen Unterschiede
Die unterschiedlichen Wirkmechanismen haben klinisch relevante Konsequenzen. Amphetamine führen zu einer stärkeren Dopamin-Freisetzung, was als „Fluten“ des synaptischen Spalts mit Dopamin beschrieben werden kann. Im Gegensatz dazu bewirkt Methylphenidat eine subtilere, indirektere Erhöhung der Dopamin-Verfügbarkeit durch Blockade der Rückaufnahme.
Diese Unterschiede können das differentielle Ansprechen einzelner Patienten erklären. Studien haben gezeigt, dass von 174 Patienten in sechs Crossover-Studien 48 besser auf Amphetamine, 27 besser auf Methylphenidat und mindestens 72 auf beide Substanzen ansprachen. Dies ergibt eine Gesamt-Response-Rate von über 87%, wenn beide Substanzklassen sequentiell versucht werden. Ein Patient, der auf ein Stimulans nicht anspricht, sollte daher das andere versuchen.
3. Quantitative EEG-Biomarker bei ADHS
3.1 Das Theta/Beta-Ratio
Das Theta/Beta-Ratio (TBR) war historisch einer der am häufigsten untersuchten EEG-Parameter bei ADHS. Zahlreiche Studien berichteten, dass ADHS durch erhöhte Theta-Aktivität und reduzierte Beta-Aktivität charakterisiert ist, was zu einem erhöhten TBR führt. In einer Multi-Center-Studie konnte das TBR ADHS-Patienten von Kontrollen mit einer Sensitivität von 86-90% und einer Spezifität von 94-98% unterscheiden.
Eine umfassende Meta-Analyse von neun Studien mit insgesamt 1253 Kindern und Jugendlichen mit ADHS und 517 Kontrollen fand jedoch, dass das TBR nicht als verlässlicher diagnostischer Marker für ADHS betrachtet werden kann. Die mittlere Effektstärke betrug 0,75 für 6-13-Jährige und 0,62 für 6-18-Jährige, wobei signifikante Heterogenität zwischen den Studien bestand.
Neuere Untersuchungen haben gezeigt, dass erhöhte TBR-Werte bei ADHS teilweise durch verlangsamte Alpha-Peak-Frequenzen erklärt werden können, was das TBR zu einem unspezifischen Maß macht, das verschiedene neurophysiologische Subgruppen kombiniert. Dennoch behält das TBR prognostischen Wert: Ein erhöhtes basales Theta und ein hohes TBR sind mit einem guten Ansprechen auf Stimulanzien assoziiert.
3.2 Alpha-Peak-Frequenz als Prädiktor
Die individuelle Alpha-Peak-Frequenz (APF) hat sich als vielversprechender Biomarker zur Vorhersage des Therapieansprechens erwiesen. Eine niedrige APF wurde als Biomarker identifiziert, der mit Non-Response auf Stimulanzien bei männlichen ADHS-Patienten assoziiert ist. Interessanterweise ist die niedrige APF auch mit Non-Response auf Antidepressiva assoziiert, was darauf hindeutet, dass sie als genereller Biomarker für Non-Response dienen und bei der Entwicklung neuer Behandlungen für solche Subgruppen helfen könnte.
Die iSPOT-A-Studie (International Study to Predict Optimized Treatment for ADHD), eine multizentrische, internationale, prospektive Open-Label-Studie mit 336 Kindern und Jugendlichen mit ADHS, untersuchte TBR und APF als Prädiktoren für das Methylphenidat-Ansprechen. 62% der ADHS-Gruppe wurden als Responder klassifiziert. Responder unterschieden sich nicht von Non-Respondern in Alter, Medikamentendosis oder Baseline-Schweregrad der ADHS-Symptome.
3.3 EEG-Spektralleistung bei Erwachsenen
Für erwachsene ADHS-Patienten zeigen Studien, dass die EEG-Spektralleistung, nicht aber das TBR, als Neuromarker fungieren kann. Eine Machine-Learning-Klassifikationsanalyse ergab, dass die besten Prädiktoren für den ADHS-Status erhöhte Leistung in Delta, Theta und niedrigem Alpha über zentro-parietalen Regionen sowie in frontalem niedrigem Beta und parietalem mittlerem Beta waren.
Bei Erwachsenen mit ADHS wurden gegenüber Kontrollen konsistent erhöhte absolute und relative Theta-Leistung sowie Alpha-Aktivität gefunden, zusammen mit einer generellen Reduktion der neuralen Aktivität bei Aufgaben, die Aufmerksamkeit erfordern. Keine konsistente Evidenz für ein atypisches TBR bei erwachsener ADHS wurde gefunden, was darauf hindeutet, dass das TBR möglicherweise ein Charakteristikum der kindlichen ADHS ist.
4. Ereigniskorrelierte Potenziale (ERPs)
4.1 Die P300-Komponente bei ADHS
Die P300 (oder P3) ist eine ERP-Komponente, die attentionale und Gedächtnisprozesse reflektiert. Sie kann in P3a- und P3b-Subkomponenten unterteilt werden. Eine aktuelle Meta-Analyse von 52 Artikeln kam zu dem Schluss, dass Gruppenunterschiede zwischen ADHS und Kontrollprobanden am robustesten für späte ERPs waren. Die ADHS-Gruppe zeigte kleinere Cue-P300-Amplituden, längere Go-P300-Latenzen und kleinere NoGo-P300-Amplituden im Vergleich zur Nicht-ADHS-Gruppe.
Die P3a wird als Reflexion der Frontallappenfunktion betrachtet und tritt auf, wenn die Aufmerksamkeit von häufigen Zielreizen auf neuartige oder seltene Reize umgelenkt wird. Sie ist mit frühen kognitiven Prozessen wie Aufmerksamkeitsmechanismen und Arbeitsgedächtnis verbunden und wird durch dopaminerge Aktivität beeinflusst. Die P3b hingegen reflektiert spätere Verarbeitung in temporal-parietalen Regionen und ist mit Gedächtnisaktualisierung und -speicherung assoziiert.
4.2 Effekte von Methylphenidat auf ERPs
Eine systematische Übersicht und Meta-Analyse der Methylphenidat-Effekte auf die P300 bei ADHS ergab, dass beim Vergleich der Prä- und Post-Effekte von MPH bei denselben Individuen die P300-Amplitude nach Verabreichung in zentralen und posterioren Regionen tendenziell zunimmt. Eine Moderationsanalyse nach Aufgabentyp zeigte eine größere Effektstärke für Go/No-Go-Aufgaben.
In einer Studie mit 26 Jungen mit ADHS zeigten die EEG-Ergebnisse nach 8 Wochen Methylphenidat-Behandlung eine Reduktion der NoGo-P300-Latenz an den Elektroden Fz, Cz und Pz im Vergleich zur Baseline. Die Normalisierung der P300-Latenz nach MPH-Behandlung scheint ein verlässlicher neuraler Biomarker für ein positives Therapieansprechen bei Kindern mit ADHS zu sein. MPH war mit Verbesserungen der exekutiven Funktionen verbunden, insbesondere in der inhibitorischen Kontrolle und dem Arbeitsgedächtnis.
4.3 P300-Topographie als Prädiktor für Therapieansprechen
Die auditorische P300-Topographie kann das Ansprechen auf Stimulanzien bei ADHS-Patienten vorhersagen. Patienten mit einem rechten fronto-zentralen zu parietalen auditorischen P300-Amplituden-Ratio von mehr als 0,5 reagieren robust auf Stimulanzien. Eine Studie bestätigte, dass die P300-Amplitude an der Elektrode T8 das Ansprechen auf Methylphenidat vorhersagen kann, wobei ein Wert von mehr als 7,65 µV Response prädizierte.
Die mittlere 31-Elektroden-P300-Amplitude konnte das Ansprechen auf Atomoxetin vorhersagen. Verschiedene P300-Parameter könnten somit bei der Vorhersage helfen, ob ein Stimulans oder ein Medikament mit einem anderen Wirkmechanismus verwendet werden sollte. Ein ERP-basierter Index zur Vorhersage des Medikamentenansprechens unterschied in einer Studie mit 87 pädiatrischen ADHS-Patienten signifikant zwischen Respondern und Non-Respondern mit einer großen und klinisch bedeutsamen Effektstärke von 1,84.
4.4 Differentielle ERP-Marker für Methylphenidat vs. Amphetamine
Ogrim und Kollegen haben wiederholt gefunden, dass attenuierte Prä-Behandlungs-P3-Amplituden während einer Cued-Go/No-Go-Aufgabe ein positives Verhaltensansprechen auf Methylphenidat oder Dexamphetamin-Stimulanzien vorhersagen. ADHS-Symptome, die mit atypischen Mustern der intrinsischen neuralen Aktivität assoziiert sind, könnten weniger responsiv auf Methylphenidat sein. Im Gegensatz dazu könnten ADHS-Symptome, die mit abnormaler frontal-striataler Netzwerkerregung assoziiert sind, durch Methylphenidat korrigierbar sein.
Bei der Untersuchung der EEG-Korrelate des Methylphenidat-Ansprechens bei ADHS zeigte sich, dass die Medikamentenverabreichung zu erhöhter Alpha-Aktivität in zentralen und parietalen Regionen führte. Kinder, die auf die Medikation ansprachen, zeigten erhöhte frontale Beta-Aktivität, während Non-Responder eine verringerte Beta-Aktivität in derselben Region zeigten. Erhöhte frontale Beta-Aktivität war signifikant mit medikamentenbezogenen Verbesserungen in Daueraufmerksamkeit und Reaktionsinhibition korreliert.
5. EEG-Microstates als funktionelle Biomarker
5.1 Grundlagen der Microstate-Analyse
EEG-Microstates repräsentieren einen alternativen Ansatz zur Untersuchung großräumiger kortikaler Dynamiken bei ADHS. Die Microstate-Analyse modelliert das spontane EEG als Sequenz von Zuständen, die durch das wiederkehrende Auftreten bestimmter Verteilungen von Skalppotenzialen definiert sind. Diese verschiedenen Zustände bleiben etwa 100 Millisekunden stabil und wechseln von einem zum anderen.
Neurowissenschaftler unterscheiden typischerweise fünf Haupt-Microstates (A bis E), die unterschiedliche räumliche Konfigurationen im elektrischen Feld des EEGs manifestieren. Die Microstate-Technik betrachtet die kombinierten räumlichen und zeitlichen Aspekte der Gehirnaktivität und hat den Vorteil, die volle räumliche Auflösung von High-Density-EEG-Aufnahmen zu nutzen.
5.2 Microstate-Alterationen bei ADHS
Eine wegweisende Studie von Férat und Kollegen untersuchte EEG-Microstates als neuartige funktionelle Biomarker für erwachsene ADHS anhand zweier unabhängiger Datensätze. Räumlich zeigten ADHS- und Kontrollprobanden äquivalente Microstate-Topographien (kanonische Karten), was auf eine Erhaltung prototypischer EEG-Generatoren bei ADHS hinweist. Diese Übereinstimmung ging jedoch mit signifikanten Unterschieden in der zeitlichen Dynamik einher.
Auf Gruppenebene und über beide Datensätze hinweg war die ADHS-Diagnose mit längeren mittleren Dauern einer fronto-zentralen Topographie (Microstate D) assoziiert. Dies deutet darauf hin, dass seine elektrokortikalen Generatoren als ausgeprägte „Attraktoren“ der globalen kortikalen Dynamik fungieren könnten. Zusätzlich wurden in einem der Datensätze Hinweise auf verringerte Zeitabdeckung und mittlere Dauer von Microstate A gefunden, die invers mit ADHS-Scores korrelierten, während Microstate-D-Metriken mit Schlafstörungen korreliert waren.
5.3 Microstate D und Aufmerksamkeitsfunktionen
Microstate D wurde wiederholt mit Aufmerksamkeitsfunktionen und Gehirnregionen in dorsalen Aufmerksamkeitsnetzwerken in Verbindung gebracht. Bei ADHS-Patienten zeigt sich oft ein Überschuss an Microstate D, einem Zustand, der durch fronto-zentrale kortikale Aktivität charakterisiert ist. Eine aktuelle Übersichtsarbeit über 13 Studien, die Microstate-Analysen auf Ruhe- und aufgabenbasierte Gehirnaktivität bei ADHS-Populationen anwendeten, bestätigte konsistent Veränderungen in der Microstate-Organisation mit erhöhter Dauer (MS-D) und Veränderungen in der zeitlichen Dynamik (MS-C).
Diese Veränderungen reflektieren möglicherweise exekutive Dysfunktionen und verzögerte Reifung des Default-Mode-Netzwerks. Microstate B zeigte vielversprechendes Potenzial bei der Unterscheidung zwischen ADHS-Subtypen basierend auf Unterschieden in der visuellen Netzwerkfunktion. Aufgabenbasierte und ERP-Studien unter Verwendung von Paradigmen wie der Continuous Performance Task oder Go/No-Go-Aufgabe identifizierten Microstate-Abnormalitäten, die mit Inhibition und Aufmerksamkeitsressourcen-Allokation verbunden sind.
6. Klinische Effektivität und Netzwerk-Meta-Analysen
6.1 Vergleichende Wirksamkeit bei Kindern und Jugendlichen
Die umfassendste Netzwerk-Meta-Analyse zur vergleichenden Wirksamkeit und Verträglichkeit von ADHS-Medikamenten analysierte doppelblinde, randomisierte kontrollierte Studien zu Amphetaminen, Atomoxetin, Bupropion, Clonidin, Guanfacin, Methylphenidat und Modafinil. Bei Kindern und Jugendlichen waren basierend auf Kliniker-Ratings alle Medikamente besser als Placebo.
In direkten Vergleichen wurden nur Unterschiede in der Wirksamkeit (Kliniker-Ratings) gefunden, wobei Amphetamine Modafinil, Atomoxetin und Methylphenidat sowohl bei Kindern und Jugendlichen als auch bei Erwachsenen überlegen waren. Die standardisierten Mittelwertdifferenzen betrugen bei Kindern und Jugendlichen -0,46 bis -0,24 zugunsten von Amphetaminen. Bei Erwachsenen lagen die Werte bei -0,94 bis -0,29.
6.2 Risiko-Nutzen-Profil
Eine wichtige Studie aus dem New England Journal of Medicine verglich das Psychose-Risiko zwischen Amphetaminen und Methylphenidat bei Jugendlichen und jungen Erwachsenen mit ADHS. Die Psychose-Rate war niedrig (1 von 660), aber bedeutsam höher für Amphetamine im Vergleich zu Methylphenidat (doppeltes Risiko). Dies ist konsistent mit dem Wirkmechanismus, da das „Fluten“ der Nervenenden mit Dopamin durch vermehrte Freisetzung dem biologischen Geschehen bei Schizophrenie näher kommt.
Hinsichtlich der Lebensqualität zeigten Meta-Analysen, dass Amphetamine (Hedges g = 0,51), Methylphenidat (0,38) und Atomoxetin (0,30) signifikant wirksamer waren als Placebo bei der Verbesserung der Lebensqualität bei Menschen mit ADHS. Diese Ergebnisse unterstreichen die Bedeutung von ADHS-Medikamenten nicht nur bei der Linderung von Kernsymptomen, sondern auch bei der Verbesserung der allgemeinen Lebensqualität.
7. Integration der Biomarker in die personalisierte Medizin
7.1 EEG-Phänotypen und Therapieprädiktion
Die allgemeine Bevölkerung kann in neun EEG-Phänotypen unterteilt werden, wobei dieselben Phänotypen auch in der ADHS-Population gefunden werden. Einige dieser Phänotypen („frontales Langsam“, „verlangsamte Alpha-Peak-Frequenz“ und „niedriges Spannungs-EEG“) differenzieren zwischen ADHS und normalen Kontrollen, wobei ADHS-Patienten extremere Werte zeigen.
Die „frontale Langsam“-Variante ist Stimulanzien-responsiv. Die langsamere Alpha-Variante hingegen ist nicht Stimulanzien-responsiv und hat eine völlig andere Pathophysiologie. Diese Unterscheidung ist klinisch relevant, da ein erhöhtes Theta/Beta-Ratio sowohl echte erhöhte Theta-Aktivität als auch verlangsamte Alpha-Peak-Frequenzen einschließen kann, die unterschiedlich auf Stimulanzien ansprechen.
7.2 Multimodale Behandlungsansätze
Aktuelle Evidenz zeigt, dass personalisierte und multimodale Neurofeedback-Interventionen eine überlegene Behandlungswirksamkeit im Vergleich zu Neurofeedback allein und eine überlegene klinische Effektivität im Vergleich zu Medikation zeigen. Eine Meta-Analyse von fünf randomisierten kontrollierten Studien mit 305 Teilnehmern zeigte additive Effekte von EEG-Neurofeedback auf Medikamente bei globalen ADHS-Symptomen und Unaufmerksamkeitssymptomen aus Elternbeobachtungen.
Richtlinien aus aller Welt stimmen allgemein darin überein, dass ein umfassender, multimodaler Behandlungsplan entwickelt werden sollte, bei dem Kliniker, Patient und Familie eng zusammenarbeiten. Jeder Patient mit ADHS ist einzigartig, und individuelle Behandlungsstrategien, die sowohl medikamentöse als auch nicht-medikamentöse Behandlungsoptionen einbeziehen, sollten angestrebt werden.
7.3 Zukunftsperspektiven
Die Entwicklung von Behandlungsbiomarkern für psychiatrische Störungen war herausfordernd, insbesondere für heterogene neurodevelopmentale Erkrankungen wie ADHS. Vielversprechende Befunde werden selten in die klinische Praxis übersetzt, insbesondere hinsichtlich Behandlungsentscheidungen und Entwicklung neuer Therapien. Trotz dieses langsamen Fortschritts bietet die verfügbare Neuroimaging-, elektrophysiologische und genetische Literatur eine solide Grundlage für die Biomarker-Entdeckung.
EEG-basierte Assessments bieten einen kosteneffizienten und nicht-invasiven Ansatz mit Potenzial für die zukünftige Stratifizierung von Patienten zu spezifischen Behandlungen. Die Microstate-Analyse könnte auch zur Überwachung der Effekte von Stimulanzien wie Methylphenidat beitragen, indem neurophysiologische Veränderungen verfolgt werden. Die Integration von Machine-Learning mit EEG-Datenanalyse könnte die Präzision und Effektivität von Neurofeedback-Protokollen verbessern.
8. Schlussfolgerungen
Die Differenzierung zwischen Methylphenidat und Amphetaminen bei der ADHS-Behandlung basiert auf fundamentalen pharmakologischen Unterschieden: Während Methylphenidat primär als Wiederaufnahmehemmer wirkt, bewirken Amphetamine zusätzlich eine aktive Freisetzung von Katecholaminen. Diese Mechanismen haben direkte Implikationen für das klinische Ansprechen und das Nebenwirkungsprofil.
Elektrophysiologische Biomarker bieten vielversprechende Möglichkeiten zur Therapieprädiktion und -optimierung. Das Theta/Beta-Ratio hat prognostischen Wert für Stimulanzien-Response, obwohl es nicht als diagnostischer Marker geeignet ist. Die Alpha-Peak-Frequenz kann Non-Response vorhersagen. P300-Amplitude und -Topographie können zwischen Respondern und Non-Respondern unterscheiden. EEG-Microstates, insbesondere Microstate D, eröffnen neue Perspektiven als funktionelle Biomarker bei ADHS.
Netzwerk-Meta-Analysen unterstützen Methylphenidat als erste Wahl bei Kindern und Jugendlichen und Amphetamine bei Erwachsenen. Die Kombination von EEG-Biomarkern mit klinischen Parametern könnte eine individualisierte Behandlungsstrategie ermöglichen und einen wichtigen Schritt in Richtung personalisierter Medizin bei ADHS darstellen.
Zukünftige Forschung sollte sich auf standardisierte Methodologien, größere Stichproben und die systematische Evaluation personalisierter und multimodaler Behandlungsansätze konzentrieren. Die Integration von Machine-Learning-Techniken in die EEG-Analyse könnte die diagnostische Genauigkeit verbessern und die Identifikation von ADHS-Subtypen erleichtern.
Literaturverzeichnis
Hinweis: Diese Abhandlung basiert auf peer-reviewed Publikationen aus PubMed, Frontiers, Nature, Lancet Psychiatry, European Neuropsychopharmacology, Clinical Neurophysiology, JAMA und weiteren wissenschaftlichen Fachzeitschriften. Die zitierten Befunde stammen aus systematischen Reviews, Meta-Analysen und randomisierten kontrollierten Studien.
Zentrale Quellen umfassen:
- Faraone SV (2018). The Pharmacology of Amphetamine and Methylphenidate: Relevance to the Neurobiology of ADHD. Neuroscience & Biobehavioral Reviews.
- Cortese S et al. (2018). Comparative efficacy and tolerability of medications for ADHD. Lancet Psychiatry.
- Arns M et al. (2018). Electroencephalographic biomarkers as predictors of methylphenidate response. European Neuropsychopharmacology.
- Arns M et al. (2013). A decade of EEG Theta/Beta Ratio Research in ADHD: a meta-analysis. Journal of Attention Disorders.
- Férat V et al. (2022). Electroencephalographic Microstates as Novel Functional Biomarkers for Adult ADHD. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging.
- Berchio C (2025). EEG Microstates in the Study of ADHD: A Review of Preliminary Evidence. Psychophysiology.
- Peisch V et al. (2021). Sensory Processing and P300 ERP Correlates of Stimulant Response in Children with ADHD. Clinical Neurophysiology.
- Barroso BCR et al. (2025). Methylphenidate and P300 in ADHD: A systematic review and meta-analysis. International Journal of Psychophysiology.
- Wang TS et al. (2025). Neural markers of methylphenidate response in children with ADHD and the impact on executive function. Frontiers in Psychiatry.
- Ogrim G et al. (2014). Predicting the clinical outcome of stimulant medication in pediatric ADHD: data from qEEG, ERPs, and a go/no-go test. Neuropsychiatric Disease and Treatment.
- Sangal RB, Sangal JM (2006). ADHD: use of cognitive evoked potential (P300) to predict treatment response. Clinical Neurophysiology.
- Bellato A et al. (2022). Treatment biomarkers for ADHD: Taking stock and moving forward. Translational Psychiatry.
- Arnold LE (2000). Methylphenidate vs. Amphetamine: Comparative review. Journal of Attention Disorders.
Zusätzliche Referenzen für klinische Implementierung und Komorbiditäten:
ADHS und Angststörungen:
- Coughlin CG, Cohen SC, Mulqueen JM, Ferracioli-Oda E, Stuckelman ZD, Bloch MH (2015). Meta-Analysis: Reduced Risk of Anxiety with Psychostimulant Treatment in Children with Attention-Deficit/Hyperactivity Disorder. Journal of Child and Adolescent Psychopharmacology, 25(8), 611-617.
- The MTA Cooperative Group (1999). A 14-month randomized clinical trial of treatment strategies for attention-deficit/hyperactivity disorder. Archives of General Psychiatry, 56(12), 1073-1086.
- Zhang Y et al. (2024). Effects of ADHD and ADHD medications on depression and anxiety in children and adolescents: A systematic review and meta-analysis. Journal of Psychiatric Research.
ADHS und Tic-Störungen/Tourette-Syndrom:
- Bloch MH, Panza KE, Landeros-Weisenberger A, Leckman JF (2009). Meta-analysis: Treatment of attention-deficit/hyperactivity disorder in children with comorbid tic disorders. Journal of the American Academy of Child and Adolescent Psychiatry, 48(9), 884-893.
- Cohen SC, Mulqueen JM, Ferracioli-Oda E, Stuckelman ZD, Coughlin CG, Leckman JF, Bloch MH (2015). Meta-Analysis: Risk of Tics Associated With Psychostimulant Use in Randomized, Placebo-Controlled Trials. Journal of the American Academy of Child and Adolescent Psychiatry, 54(9), 728-736.
- Tourette Syndrome Study Group (2002). Treatment of ADHD in children with tics: a randomized controlled trial. Neurology, 58(4), 527-536.
- Pringsheim T et al. (2019). Practice guideline recommendations summary: Treatment of tics in people with Tourette syndrome and chronic tic disorders. Neurology, 92(19), 896-906.
- Gadow KD et al. (2007). Immediate-release methylphenidate for ADHD in children with comorbid chronic multiple tic disorder. Journal of the American Academy of Child and Adolescent Psychiatry, 46(7), 840-848.
- Castellanos FX et al. (1997). Controlled stimulant treatment of ADHD and comorbid Tourette’s syndrome: effects of stimulant and dose. Journal of the American Academy of Child and Adolescent Psychiatry, 36(5), 589-596.
- Osland ST, Steeves TDL, Pringsheim T (2018). Pharmacological treatment for attention deficit hyperactivity disorder (ADHD) in children with comorbid tic disorders. Cochrane Database of Systematic Reviews, 6, CD007990.
ADHS und Substanzmissbrauch:
- Humphreys KL, Eng T, Lee SS (2013). Stimulant medication and substance use outcomes: a meta-analysis. JAMA Psychiatry, 70(7), 740-749.
- Chang Z, Lichtenstein P, Halldner L, D’Onofrio B, Serlachius E, Fazel S, Långström N, Larsson H (2014). Stimulant ADHD medication and risk for substance abuse. Journal of Child Psychology and Psychiatry, 55(8), 878-885.
- Wilens TE et al. (2003). Does stimulant therapy of attention-deficit/hyperactivity disorder beget later substance abuse? A meta-analytic review of the literature. Pediatrics, 111(1), 179-185.
- Quinn PD et al. (2017). ADHD medication and substance-related problems. American Journal of Psychiatry, 174(9), 877-885.
ADHS und Psychose-Risiko (Methylphenidat vs. Amphetamine):
- Moran LV, Ongur D, Hsu J, Castro VM, Perlis RH, Schneeweiss S (2019). Psychosis with Methylphenidate or Amphetamine in Patients with ADHD. New England Journal of Medicine, 380(12), 1128-1138.
- Moran LV et al. (2024). Dose-Response Association Between Prescription Amphetamines and Psychosis Risk. American Journal of Psychiatry.
Arousal-Hypothese und neuere neurobiologische Studien:
- Kay LM et al. (2025). Stimulants primarily act on arousal and reward systems in ADHD. Cell, 188(1), 1-15.
- Barry RJ, Clarke AR, Johnstone SJ, McCarthy R, Selikowitz M (2009). Electroencephalogram theta/beta ratio and arousal in attention-deficit/hyperactivity disorder: Evidence of independent processes. Biological Psychiatry, 66(4), 398-401.
EEG-basierte Differenzierung (Clarke-Studien):
- Clarke AR, Barry RJ, McCarthy R, Selikowitz M (2001). Excess beta activity in children with attention-deficit/hyperactivity disorder: an atypical electrophysiological group. Psychiatry Research, 103(2-3), 205-218.
- Clarke AR, Barry RJ, McCarthy R, Selikowitz M (2001). EEG-defined subtypes of children with attention-deficit/hyperactivity disorder. Clinical Neurophysiology, 112(11), 2098-2105.
- Clarke AR, Barry RJ, McCarthy R, Selikowitz M, Johnstone SJ, Abbott I, Croft RJ, Magee CA, Hsu CI, Lawrence CA (2002). Effects of methylphenidate on EEG coherence in attention-deficit/hyperactivity disorder. International Journal of Psychophysiology, 45(3), 185-193.
- Clarke AR, Barry RJ, McCarthy R, Selikowitz M, Brown CR, Croft RJ (2003). Effects of stimulant medications on the EEG of children with Attention-Deficit/Hyperactivity Disorder Predominantly Inattentive type. International Journal of Psychophysiology, 47(2), 129-137.
Alpha-Peak-Frequenz als Prädiktor:
- Voetterl HTA et al. (2023). Alpha peak frequency-based Brainmarker-I as a method to stratify to pharmacotherapy and brain stimulation treatments in depression. Nature Mental Health, 1, 1-12.
- Arns M et al. (2018). Electroencephalographic biomarkers as predictors of methylphenidate response in attention-deficit/hyperactivity disorder. European Neuropsychopharmacology, 28(8), 881-891.
- Buyck I, Wiersema JR (2014). Resting electroencephalogram in attention deficit hyperactivity disorder: developmental course and diagnostic value. Psychiatry Research, 216(3), 391-397.
- Shaw P et al. (2007). Attention-deficit/hyperactivity disorder is characterized by a delay in cortical maturation. Proceedings of the National Academy of Sciences, 104(49), 19649-19654.
Netzwerk-Meta-Analysen zur vergleichenden Wirksamkeit:
- Cortese S et al. (2018). Comparative efficacy and tolerability of medications for attention-deficit hyperactivity disorder in children, adolescents, and adults: a systematic review and network meta-analysis. Lancet Psychiatry, 5(9), 727-738.
- Defined S et al. (2025). Comparative efficacy and acceptability of pharmacological, psychological, and neurostimulatory interventions for ADHD in adults: a systematic review and component network meta-analysis. Lancet Psychiatry.